MỜI GỌI ĐẦU TƯ BẤT ĐỘNG SẢN VÀO NHẬT BẢN
03/05/2024
Thạch KIDS JELLY PREMIUM đến từ Nhật Bản – cung cấp DHA, canxi và nhiều dinh dưỡng cần thiết cho trẻ em
10/05/2024Vào năm 2015, Alka Dwivedi, khi đó là một sinh viên sau đại học tại Viện Công nghệ Ấn Độ (IIT) Bombay, bắt đầu tự hỏi liệu liệu pháp Tế bào CAR-T có thể được sản xuất tại Ấn Độ hay không.
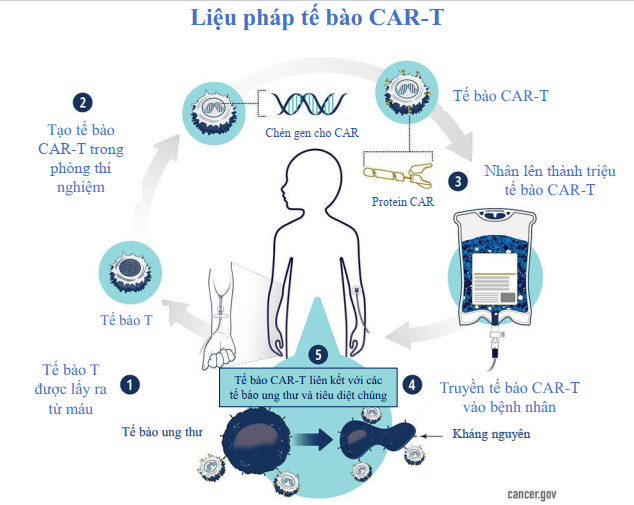
Lúc bấy giờ, một số liệu pháp Tế bào CAR-T - một loại liệu pháp miễn dịch trong đó các tế bào T của một người được chỉnh sửa trong phòng thí nghiệm để chọn lọc tiêu diệt các tế bào ung thư - đang được thử nghiệm lâm sàng tại Hoa Kỳ. Và mặc dù liệu pháp Tế bào CAR-T trông có vẻ là những phương pháp điều trị hứa hẹn cho các bệnh ung thư máu như bạch cầu và lymphoma nhưng chúng có thể gây ra các tác dụng phụ nghiêm trọng và dự kiến sẽ có mức giá cao một khi được phê duyệt sử dụng.

Sau sự chấp thuận gần đây của Ấn Độ đối với NexCAR19, bệnh nhân ung thư ở đó sẽ sớm được tiếp cận với liệu pháp tế bào CAR-T với giá cả phải chăng. Credit: iStock
Cô cảm thấy cả hai vấn đề trên đều có nghĩa là những phương pháp điều trị tiên tiến này (ít nhất là trong hình thức mà chúng được sản xuất vào thời điểm đó) sẽ không phải là một lựa chọn khả thi cho nhiều người ở các quốc gia có thu nhập thấp và trung bình như Ấn Độ. Tiến sĩ Dwivedi và các đồng nghiệp của cô đã tưởng tượng thiết kế một liệu pháp Tế bào CAR-T khác biệt, một liệu pháp có thể được sản xuất và đáp ứng nhu cầu của người mắc bệnh ung thư trong nước của họ. Họ biết rằng họ không thể làm điều đó một mình.
Trong vài năm tiếp theo, Tiến sĩ Dwivedi (người đã nhận bằng Tiến sĩ vào năm 2021) đã bắt đầu một hành trình hợp tác đã đưa cô và các đồng nghiệp là Tiến sĩ Rahul Purwar của IIT Bombay và Tiến sĩ Y khoa Gaurav Narula của Trung tâm Tata Memorial ở Mumbai đến Trung tâm Lâm sàng Quốc gia về Sức khỏe (NIH) ở Bethesda, Maryland.
Trong thời gian nghiên cứu tại Trung tâm Lâm sàng NIH, nhóm này đã theo dõi các chuyên gia hàng đầu về liệu pháp tế bào CAR-T tại Trung tâm Nghiên cứu Ung thư NCI. Sự đào tạo do các nhà khoa học NCI cung cấp - bao gồm Nirali Shah, Tiến sĩ Y khoa, người nghiên cứu liệu pháp tế bào CAR-T cho trẻ em mắc bệnh ung thư máu - đã chứng minh là vô giá, theo lời Tiến sĩ Dwivedi. Chuyến thăm đã giúp Tiến sĩ Dwivedi và các đồng nghiên cứu thiết kế một liệu pháp tế bào CAR-T hiệu quả, actalycabtagene autoleucel (NexCAR19), có thể được sản xuất tại Ấn Độ, có giá cả hợp lý và đáp ứng nhu cầu của bệnh nhân trong hệ thống chăm sóc sức khỏe của Ấn Độ.
Vào tháng 10 năm 2023, tổ chức Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ của Ấn Độ, Tổ chức Kiểm soát Tiêu chuẩn Dược phẩm Trung ương, đã chấp thuận NexCAR19 là liệu pháp tế bào CAR-T đầu tiên được phê duyệt tại Ấn Độ.
Sự chấp thuận dựa trên kết quả của hai thử nghiệm lâm sàng nhỏ được tiến hành tại Ấn Độ trong 64 người mắc bệnh lymphoma hoặc bệnh bạch cầu tiên tiến. Theo kết quả thử nghiệm được trình bày vào tháng 12 năm 2023 tại cuộc họp của Hội Huyết học Mỹ, 67% bệnh nhân (36 trên 53) trong hai thử nghiệm đã có sự giảm đáng kể về mức độ ung thư của họ (phản ứng khách quan), với ung thư biến mất hoàn toàn ở khoảng một nửa (phản ứng hoàn toàn).
ImmunoACT, một công ty con của IIT Bombay, đã tài trợ cho thử nghiệm và sẽ sản xuất actalycabtagene autoleucel và đưa nó ra thị trường
Tiến sĩ Dwivedi, người hiện đang tiếp tục đào tạo tại Trung tâm Nghiên cứu Ung thư của NCI cho biết: “Đây là một thành tựu lớn đối với Ấn Độ”. “Chính nỗ lực của cả nhóm đã đưa chúng tôi đến đây.”
"Đây giống như một giấc mơ đã trở thành hiện thực và một chiến thắng không tưởng cho bệnh nhân ở Ấn Độ,"Tiến sĩ Purwar, người đã là cố vấn sau đại học của Tiến sĩ Dwivedi tại IIT Bombay và là người sáng lập kiêm Giám đốc điều hành của ImmunoACT, nói trong một tuyên bố. "Bây giờ bệnh nhân của chúng tôi ở Ấn Độ và các quốc gia có nguồn lực hạn chế sẽ có quyền truy cập vào loại thuốc cứu mạng này với một chi phí phải chăng".
Thiết kế liệu pháp tế bào CAR-T nội địa
Ở Ấn Độ, ung thư đang trở thành một vấn đề sức khỏe cộng đồng lớn hơn nhiều so với trước đây. Theo ước tính gần đây nhất, số ca chẩn đoán ung thư mới trong nước đã đạt gần 1,6 triệu ca vào năm 2023, tăng từ khoảng 980.000 ca vào năm 2010. Và ước tính có 800.000 người chết vì ung thư mỗi năm, một con số dự kiến sẽ tăng đáng kể trong những thập kỷ tới.
Mặc dù gánh nặng ung thư ở Ấn Độ đang ngày càng tăng, nhiều phương pháp điều trị ung thư mới lại không thể tiếp cận được do chi phí cao và thiếu bảo hiểm y tế chung cho người dân Ấn Độ. Ngoài ra, một số phương pháp điều trị, bao gồm cả liệu pháp tế bào CAR-T, có thể gây ra tác dụng phụ nghiêm trọng cần phải được điều trị tại bệnh viện, làm tăng thêm chi phí điều trị và yêu cầu tiếp nhận vào bệnh viện (điều này không phải là trường hợp của nhiều người trong nước).
Ở Hoa Kỳ, sáu liệu pháp tế bào CAR-T đã được phê duyệt để điều trị ung thư máu, chủ yếu là lymphoma và một số dạng bệnh bạch cầu, và gần đây nhất là đa u tủy. Nhưng tất cả các liệu pháp được phê duyệt này đều chứa các đoạn kháng thể được phái sinh từ chuột, có thể gây ra tác dụng phụ nghiêm trọng khi hệ thống miễn dịch của bệnh nhân cố gắng loại bỏ chất lạ.
Sử dụng một phương pháp tương tự như một phương pháp đang được các nhóm nghiên cứu ở Hoa Kỳ và nơi khác theo đuổi, Tiến sĩ Dwivedi và các đồng nghiệp của cô đã cố gắng chỉnh sửa tế bào CAR-T để mang một loại kháng thể giống người hơn. Họ hy vọng rằng liệu pháp tế bào CAR-T "nhân hóa" này sẽ tránh được sự tấn công của hệ thống miễn dịch.
Nhưng những nỗ lực ban đầu của họ trong việc thiết kế loại tế bào CAR-T như vậy không thành công, và họ không thể hiểu tại sao. Đó là khi họ quyết định tìm kiếm sự hướng dẫn từ bên ngoài.
"Chúng tôi nghĩ rằng chúng tôi nên đến NCI và được đào tạo," Tiến sĩ Dwivedi nói.
Học hỏi từ các nhà lãnh đạo
Các nhà nghiên cứu đã đến NCI vào cuối năm 2017 thông qua một chương trình nhà khoa học khách mời do Trung tâm Sức khỏe Toàn cầu của NCI tài trợ. Ngoài việc làm việc với Tiến sĩ Shah, Tiến sĩ y khoa Terry Fry, và các đồng nghiệp để tìm hiểu thêm về việc thiết kế tế bào CAR-T, nhóm cũng đã làm việc với Tiến sĩ Steven L. Highfill, Tiến sĩ Y khoa David F. Stroncek, và đội ngũ của họ từ Trung tâm Kỹ thuật Tế bào của NIH để nhận đào tạo nâng cao về sản xuất liệu pháp tế bào.
"Họ muốn học toàn bộ quy trình," Tiến sĩ Shah nói. Điều đó bao gồm mọi thứ từ cách sản xuất tế bào CAR-T có chất lượng đủ cao để sử dụng cho con người đến cách thiết kế một thử nghiệm lâm sàng để kiểm tra liệu pháp của họ.
Tiến sĩ Dwivedi cho biết trải nghiệm theo dõi các nhà khoa học NCI đã là một bước ngoặt cho nhóm của cô. Khi họ trở về Ấn Độ, họ đã thành công trong việc sản xuất một số phiên bản của liệu pháp tế bào CAR-T nhân hóa. Tiến sĩ Shah và các đồng nghiệp của cô tại NCI cũng đã thực hiện nhiều chuyến đi đến Ấn Độ để giúp đỡ nhóm IIT Bombay/Tata khi họ tiến hành quy trình sản xuất.
Khi Tiến sĩ Dwivedi và các đồng nghiệp của cô thử nghiệm các phiên bản khác nhau trong phòng thí nghiệm và nghiên cứu trên động vật, một phiên bản đã nổi bật với khả năng tiêu diệt tế bào ung thư đồng thời hạn chế các phản ứng liên quan đến miễn dịch có thể dẫn đến tác dụng phụ nghiêm trọng. Actalycabtagene autoleucel, giống như hầu hết các liệu pháp tế bào CAR-T được phê duyệt ở Hoa Kỳ, nhắm mục tiêu vào CD19, một protein thường được sản xuất với số lượng lớn trên bề mặt của tế bào bạch cầu và lymphoma.
Với một liệu pháp hứa hẹn trong tay, đã đến lúc thực hiện bước tiếp theo: thử nghiệm lâm sàng.
Kết quả thử nghiệm lâm sàng ấn tượng
Vào ngày 4 tháng 6 năm 2021, một bệnh nhân tại Bệnh viện Tata Memorial ở Mumbai đã nhận được liều truyền đầu tiên của actalycabtagene autoleucel, liệu pháp tế bào CAR-T mà sau này sẽ trở thành NexCAR19. Phần đầu tiên của thử nghiệm lâm sàng này chỉ bao gồm 14 bệnh nhân, tất cả đều mắc bệnh bạch cầu lymphoblastic cấp tính B-cell đã tái phát hoặc không đáp ứng với các phương pháp điều trị tiêu chuẩn.
Dựa trên kết quả hứa hẹn từ 14 bệnh nhân đầu tiên, một thử nghiệm lớn hơn một chút đã nhanh chóng được khởi động. Các thử nghiệm kết hợp bao gồm 64 người mắc bệnh lymphoma B-cell hoặc bệnh bạch cầu.
Tại cuộc họp của Hội Huyết học Mỹ, đồng sáng lập ImmunoACT, Tiến sĩ Atharva Karulkar và Tiến sĩ Y khoa Hasmukh Jain của Trung tâm Tata Memorial, người đã dẫn dắt thử nghiệm lâm sàng, đã trình bày dữ liệu từ các thử nghiệm. Trong số 53 bệnh nhân có thể đánh giá (38 người mắc lymphoma và 15 người mắc bệnh bạch cầu), 26 trên 38 bệnh nhân mắc lymphoma (68%) và 10 trên 15 bệnh nhân mắc bệnh bạch cầu (72%) đã phản ứng với điều trị. Tất cả các phản ứng trong nhóm bệnh bạch cầu đều là phản ứng hoàn toàn - tức là họ không còn dấu hiệu của bệnh ung thư.
Không có bệnh nhân nào trong số 53 người tham gia gặp phải tác dụng phụ về thần kinh thường thấy ở những người được điều trị bằng liệu pháp tế bào CAR-T được phê duyệt ở Hoa Kỳ, và chỉ một phần nhỏ (5%) gặp phải hình thức nghiêm trọng của tác dụng phụ liên quan đến miễn dịch được biết đến với tên gọi hội chứng giải phóng cytokine.
Chỉ có năm bệnh nhân cần nhập viện do tác dụng phụ.
Một mô hình cho khoa học nhóm toàn cầu
Tiến sĩ Karulkar đã lưu ý trong bài thuyết trình của mình rằng, ở Hoa Kỳ, một liều truyền liệu pháp tế bào CAR-T có giá khoảng 400.000 đô la. Ngược lại, NexCAR19 dự kiến sẽ có giá khoảng 50.000 đô la. ImmunoAct sẽ sản xuất tế bào CAR-T tại một cơ sở đang được xây dựng ở Mumbai và có kế hoạch phát triển thêm các địa điểm sản xuất khắp Ấn Độ. Ban đầu, họ hy vọng sẽ điều trị cho khoảng 1.200 bệnh nhân mỗi năm.
"Thật đáng chú ý khi họ có thể tạo ra một liệu pháp tế bào CAR-T hoàn toàn mới phù hợp với kết quả... đang được thấy ở Hoa Kỳ," Tiến sĩ Shah nói. "Thực tế là họ đã có thể giữ chi phí thấp và đưa ra một phương pháp điều trị được dung nạp tương đối tốt - điều này quan trọng đối với dân số bệnh nhân mà họ sẽ điều trị ở Ấn Độ - có nghĩa là họ sẽ cải thiện cuộc sống của rất nhiều người."
Tiến sĩ Shah chỉ ra rằng thành tựu này vượt xa việc phát triển liệu pháp tế bào CAR-T đầu tiên của Ấn Độ. Thông qua nỗ lực hợp tác này, Tiến sĩ Dwivedi và các đồng nghiệp của cô đã xây dựng một cái gì đó mà các quốc gia có thu nhập thấp và trung bình khác có thể làm mô hình.
"Những gì Tiến sĩ Dwivedi và nhóm của cô ấy phát triển là toàn bộ cơ sở hạ tầng liệu pháp tế bào," Tiến sĩ Shah nói. Họ đã chứng minh cho các cơ quan y tế công cộng ở các quốc gia khác rằng họ cũng "có khả năng xây dựng những liệu pháp này từ dưới lên".